L'infertilità femminile
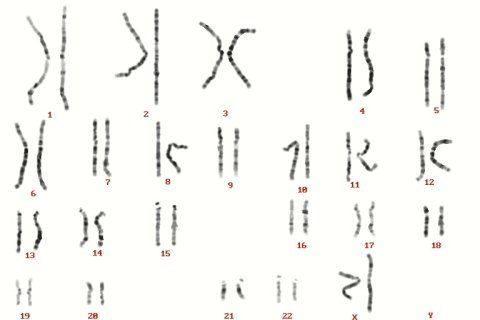
Il cariotipo sul sangue
L’esame di “analisi del cariotipo su sangue” consente di analizzare il corredo cromosomico di un individuo a partire da un semplice prelievo di sangue. Questo esame è in grado di rivelare:
- La presenza di alterazioni di numero o di struttura dei cromosomi sessuali (cromosoma X, cromosoma Y) che possono essere associati a patologie dello sviluppo sessuale (sindrome di Turner, sindrome di Klinefelter) normalmente causa di infertilità; spesso anche un soggetto fenotipicamente normale può presentare un corredo cromosomico a mosaico per queste alterazioni (es: cellule normali 46,XX/cellule alterate 45,X) evidenziabile solo mediante l’analisi del cariotipo;
- La presenza di riarrangiamenti cromosomici bilanciati presenti in individui clinicamente sani, che danno origine a gameti sbilanciati, causa di infertilità, ridotta fertilità, poliabortività, nascita di feti affetti da patologie cromosomiche.
Le anomalie cromosomiche svolgono un ruolo di primaria importanza tra le cause di infertilità maschile e femminile.
Queste alterazioni, se presenti nel corredo cromosomico di un individuo, possono:
- interferire direttamente sulla differenziazione sessuale della persona e quindi sulle sue capacità riproduttive;
- causare la formazione di gameti portatori di anomalie cromosomiche e pertanto con difficoltà a fecondare (se spermatozoi) o ad essere fecondati (se ovociti);
- in caso di successo di fecondazione, tali gameti alterati possono generare feti patologici che, ove non vengano abortiti spontaneamente, causano la nascita di neonati con anomalie multiple.
La tecnica
Campione richiesto: sangue in eparina
Tempo di refertazione: 25 giorni
Cosa si analizza: Il corredo cromosomico dell’individuo
Metodo analitico: Coltura cellulare linfocitaria
Consulenza genetica: Fornita dallo specialista in Genetica prima dell’esecuzione dell’esame e alla consegna del referto per l’interpretazione del risultato
La Trombofilia ereditaria
La trombofilia ereditaria (predisposizione genetica alla trombosi) determina un aumentato rischio di eventi trombotici. Tali eventi sono frequentemente causati da alterazioni di uno o più fattori della coagulazione del sangue. Le donne affette da trombofilia ereditaria hanno una maggiore predisposizione ad aborti spontanei (abortività ricorrente). Nella maggior parte dei casi la morte del feto è causata da alterazioni sul gene fattore V o sul gene del fattore II che determinano l'instaurarsi di una trombosi placentare, caratterizzata da una ostruzione dei vasi sanguigni placentari. Inoltre le donne che presentano mutazioni sul gene MTHFR associate ad elevati livelli di omocisteina nel sangue, in gravidanza presentano un aumentato rischio di aborto e di difetti del tubo neurale. Tali donne necessitano di una maggiore quantità di acido folico durante il periodo periconcezionale allo scopo di ridurre tale rischio.
Gene Fattore V
Il fattore V attivato è un cofattore essenziale per l'attivazione della protrombina (fattore II) a trombina. La variante genetica R506Q, definita variante di Leiden, causa una maggiore attività pro- coagulante del fattore V attivato che predispone alla trombosi. La frequenza dei portatori in Italia è pari al 3%. I soggetti eterozigoti (portatori di una sola copia della variante ) hanno un rischio 8 volte superiore di sviluppare una trombosi venosa, mentre gli omozigoti (portatori di entrambe le copie) hanno un rischio pari ad 80 volte. Tale evento trombotico è favorito in presenza di altre condizioni predisponenti quali la gravidanza, l'assunzione di contraccettivi orali, gli interventi chirurgici.Nuov
Recentemente sono state individuate altre 2 mutazioni sul gene del fattore V: la prima (H1299R) comporta un ulteriore aumento di rischio trombotico nei portatori della mutazione fattore V di Leiden. La seconda ( Y1702C ) causa un ulteriore aumento del rischio trombotico se è presente contemporaneamente la mutazione fattore V di Leiden o la mutazione G1299R.o
Gene MTHFR
La metilentetraidrofolatoreduttasi (MTHFR) è un enzima coinvolto nel metabolismo dell’omocisteina. In particolare agisce nella trasformazione del 5-10 metilentetraidrofolato in 5 metiltetraidrofolato che serve come donatore di metili per la rimetilazione della omocisteina a metionina tramite l'intervento della vitamina B12. Alcune varianti di questo enzima sono meno efficienti nella loro attività e questa ridotta efficienza è associata con un aumento di omocisteina nel sangue.Il
Le varianti del gene MTHFR associate ad elevati livelli di omocisteina nel sangue sono la C677T e la A1298C.
Livelli aumentati di omocisteina sono oggi considerati fattore di rischio per malattia vascolare, (trombosi arteriosa). Inoltre, se la dieta è carente di acido folico queste varianti MTHFR causano una netta riduzione dei livelli di acido folico nel plasma, diventando un importante fattore di rischio per i difetti del tubo neurale nelle donne in gravidanza. Condizioni di eterozigosi doppia, specie con la variante Leiden del fattore V o con la variante 20210 del Fattore II, possono incrementare il rischio relativo per il tromboembolismo venoso.
Gene Fattore II
La protrombina o fattore II della coagulazione svolge un ruolo fondamentale nella cascata coagulativa in quanto la sua attivazione in trombina porta alla trasformazione del fibrinogeno in fibrina e quindi alla formazione del coagulo.
La variante genetica G20210A è associata ad elevati livelli di protrombina funzionale nel plasma e conseguente aumentato rischio di trombosi, specie di tipo venosa.I
La frequenza degli eterozigoti (portatori di una sola copia della variante) nella popolazione è del 3 %. Tali soggetti hanno un rischio di trombosi venosa 3 volte superiore rispetto alla popolazione generale.l
La compresenza della mutazione FV Leiden aumenta il rischio di trombosi di 100 volte.
Gene PAI-1
Il gene PAI-1 è un inibitore dell’attivatore del plasminogeno (PAI-1) ed è il maggiore inibitore del sistema fibrinolitico. Sul promotore di questo gene è presente una variante caratterizzata da una inserzione o delezione di una guanina (4G/5G).
La variante 4G è associata ad incrementati livelli di questo inibitore e pertanto ad una minore attività fibrinolitica. Individui omozogoti per questa variante (4G/4G) presentano un aumento del rischio trombotico, sia di tipo arterioso (infarto miocardico e malattia coronarica) che venoso (tromboembolismo).
Questo rischio è particolarmente aumentato nei soggetti fumatori e nei soggetti ipertesi. Le gestanti con genotipo 4G/4G hanno una maggiore incidenza di complicanze della gravidanza (preeclampsia) ed al parto.
La tecnica
Campione richiesto: sangue in EDTA
Tempo di refertazione: 18 giorni
Cosa si analizza: Varianti dei geni Fattore II, Fattore V, MTHFR, PAI-1
Metodo analitico: Estrazione del DNA, PCR, ibridazione con RDB (reverse dot blot)
Consulenza genetica: fornita dallo specialista in Genetica prima dell’esecuzione dell’esame e alla consegna del referto per l’interpretazione del risultato.
La tecnica
Campione richiesto: sangue in EDTA
Tempo di refertazione: 18 giorni
Cosa si analizza: Il gene della Fibrosi Cistica (CFTR) l’88% delle mutazioni del gene CFTR osservate in Italia
Metodo analitico: Estrazione del DNA, PCR ibridazione con RDB (reverse dot blot)
Consulenza genetica: fornita dallo specialista in Genetica prima dell’esecuzione dell’esame e alla consegna del referto per l’interpretazione del risultato.